Câu chuyện truyền cảm hứng
Các câu chuyện có thật được truyền cảm hứng từ người sử dụng Enzyme
Giới thiệu về Enzyme
“Enzyme có thể được định nghĩa là các polyme sinh học xúc tác các phản ứng sinh hóa.”
Phần lớn các enzym là các protein có khả năng xúc tác rất quan trọng để thực hiện các quá trình khác nhau. Các quá trình trao đổi chất và các phản ứng hóa học khác trong tế bào được thực hiện bởi một tập hợp các enzym cần thiết để duy trì sự sống.
Video giới thiệuCấu trúc Enzyme
Enzyme là một chuỗi axit amin tuyến tính, tạo ra cấu trúc ba chiều. Trình tự của các axit amin xác định cấu trúc, từ đó xác định hoạt động xúc tác của enzym. Khi đun nóng, cấu trúc của enzym biến tính, dẫn đến mất hoạt tính của enzym, thường liên quan đến nhiệt độ.
So với cơ chất của nó, các enzym thường lớn với kích thước khác nhau, từ 62 gốc axit amin đến trung bình 2500 dư lượng được tìm thấy trong tổng hợp axit béo. Chỉ một phần nhỏ của cấu trúc tham gia vào quá trình xúc tác và nằm bên cạnh các vị trí liên kết. Vị trí xúc tác và vị trí liên kết với nhau tạo thành vị trí hoạt động của enzym. Một số lượng nhỏ ribozyme tồn tại đóng vai trò như một chất xúc tác sinh học dựa trên RNA. Nó phản ứng phức tạp với protein.
Phân loại Enzyme

Trước đó, các enzym được gán tên dựa trên người đã phát hiện ra nó. Với những nghiên cứu sâu hơn, việc phân loại trở nên toàn diện hơn.
Theo Liên minh các nhà hóa sinh quốc tế (IUB), các enzym được chia thành sáu lớp chức năng và được phân loại dựa trên loại phản ứng mà chúng được sử dụng để xúc tác. Sáu loại enzyme là hydrolase, oxidoreductase, lyases, transferase, ligases và isomerase.
Dưới đây là danh sách phân loại các enzym được thảo luận chi tiết:
| Các loại | Thuộc tính sinh hóa |
| Chất oxy hóa | Enzyme Oxidoreductase xúc tác phản ứng oxy hóa trong đó các điện tử có xu hướng di chuyển từ dạng này sang dạng phân tử khác. |
| Chuyển nhượng | Các enzyme Transferase giúp vận chuyển nhóm chức năng giữa các chất nhận và các phân tử cho. |
| Hydrolase | Hydrolase là enzym thủy phân, xúc tác phản ứng thủy phân bằng cách thêm nước để phân cắt liên kết và thủy phân nó. |
| Lyases | Thêm nước, carbon dioxide hoặc amoniac qua các liên kết đôi hoặc loại bỏ chúng để tạo liên kết đôi. |
| Isomerase | Enzyme Isomerase xúc tác sự thay đổi cấu trúc có trong phân tử, do đó gây ra sự thay đổi hình dạng của phân tử. |
| Dây buộc | Enzyme Ligases được biết là phụ trách xúc tác của quá trình thắt. |
Chất oxy hóa
Những phản ứng này xúc tác cho các phản ứng oxy hóa và khử, ví dụ như pyruvate dehydrogenase, xúc tác quá trình oxy hóa pyruvate thành acetyl coenzyme A.
Chuyển hóa
Những chất này xúc tác chuyển nhóm hóa học từ hợp chất này sang hợp chất khác. Một ví dụ là transaminase, chuyển nhóm amin từ phân tử này sang phân tử khác.
Hydrolase
Chúng xúc tác quá trình thủy phân một liên kết. Ví dụ, enzym pepsin thủy phân các liên kết peptit trong protein .
Lyases
Những chất này xúc tác sự phá vỡ các liên kết mà không cần xúc tác, ví dụ như aldolase (một enzym trong quá trình đường phân) xúc tác sự phân tách fructose-1, 6-bisphosphate thành glyceraldehyde-3-phosphate và dihydroxyacetone phosphate.
Isomerase
Chúng xúc tác sự hình thành đồng phân của một hợp chất. Ví dụ: men phosphoglucomutase xúc tác chuyển glucose-1-phosphate thành glucose-6-phosphate (nhóm phosphate được chuyển từ vị trí này sang vị trí khác trong cùng một hợp chất) trong quá trình đường phân (glycogen được chuyển thành glucose để năng lượng được giải phóng nhanh chóng).
liên kết
Các chất xúc tác xúc tác sự liên kết của hai phân tử. Ví dụ, DNA ligase xúc tác việc nối hai đoạn DNA bằng cách hình thành liên kết phosphodiester.
Đồng nhân tố
Cofactors là những chất không liên quan đến protein liên kết với các enzym. Một đồng yếu tố cần thiết cho hoạt động của một enzym. Enzyme không có đồng yếu tố được gọi là apoenzyme. Một enzyme và đồng yếu tố của nó cùng nhau tạo thành holoenzyme.
Có ba loại đồng yếu tố có trong enzym:
- Nhóm giả : Đây là những đồng yếu tố luôn liên kết chặt chẽ với một enzym. Mốt là một nhóm chân tay giả có trong nhiều loại enzym.
- Coenzyme : Một coenzyme chỉ liên kết với một enzyme trong quá trình xúc tác. Tại tất cả các thời điểm khác, nó được tách ra khỏi enzyme. NAD + là một coenzyme phổ biến.
- Các ion kim loại : Đối với xúc tác của một số enzym, cần có một ion kim loại tại vị trí hoạt động để hình thành liên kết tọa độ. Zn 2+ là đồng yếu tố ion kim loại được sử dụng bởi một số enzym.
Ví dụ về Enzyme
Sau đây là một số ví dụ về enzym:
Đồ uống
Đồ uống có cồn được tạo ra bởi quá trình lên men thay đổi rất nhiều dựa trên nhiều yếu tố. Dựa trên loại sản phẩm của nhà máy sẽ được sử dụng và loại enzyme được sử dụng, sản phẩm lên men sẽ khác nhau.
Ví dụ, nho, mật ong, hoa bia, lúa mì, củ sắn và khoai tây tùy thuộc vào nguyên liệu sẵn có. Bia, rượu và các loại đồ uống khác được sản xuất từ quá trình lên men thực vật.
Sản phẩm thực phẩm
Bánh mì có thể được coi là ví dụ tốt nhất về quá trình lên men trong cuộc sống hàng ngày của chúng ta.
Một tỷ lệ nhỏ men và đường được trộn với bột để làm bánh mì. Sau đó, người ta có thể quan sát thấy rằng bánh mì bị phồng lên là kết quả của quá trình lên men đường bởi tác động của enzym trong nấm men, dẫn đến sự hình thành khí carbon dioxide. Quá trình này tạo ra kết cấu cho bánh mì, điều này sẽ bị thiếu nếu không có quá trình lên men.
Hành động
Hoạt động của enzym có thể bị ức chế hoặc thúc đẩy bằng cách sử dụng các loại thuốc có xu hướng hoạt động xung quanh các vị trí hoạt động của enzym.
Cơ chế của phản ứng Enzyme
Hai phân tử bất kỳ phải va chạm để phản ứng xảy ra đúng hướng và đủ năng lượng. Năng lượng giữa các phân tử này cần phải vượt qua rào cản trong phản ứng. Năng lượng này được gọi là năng lượng hoạt hóa.
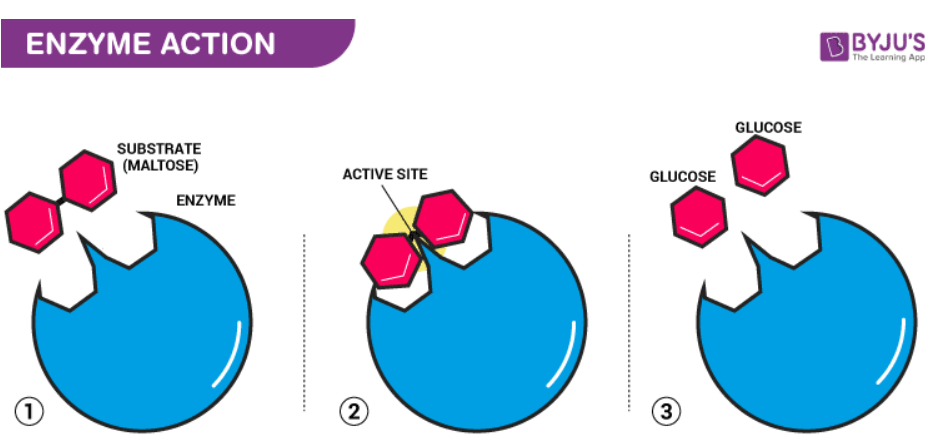
Enzyme được cho là có một vị trí hoạt động. Vị trí hoạt động là một phần của phân tử có hình dạng xác định và nhóm chức để liên kết các phân tử chất phản ứng. Phân tử liên kết với enzym được gọi là nhóm cơ chất. Cơ chất và enzyme tạo thành phản ứng trung gian có năng lượng hoạt hóa thấp mà không cần bất kỳ chất xúc tác nào.
r e a c t a n t ( 1 ) + r e a c t a n t ( 2 ) → p r o du c tr e a c t a n t ( 1 ) + e n zym e → i n t e r m e di một t đtôi n t e r m e di a t e + r e a c t a n t ( 2 ) → p r o du c t + e n zym e

Cơ chế hoạt động cơ bản của enzyme là xúc tác các phản ứng hóa học, bắt đầu bằng sự gắn kết của cơ chất với vị trí hoạt động của enzyme. Vị trí hoạt động này là một khu vực cụ thể kết hợp với chất nền.
Tương tác Enzyme-Chất nền
Enzyme là chất xúc tác sinh học với hợp chất proteinous trọng lượng phân tử cao. Nó tăng cường các phản ứng xảy ra trong cơ thể trong các quá trình sống khác nhau . Nó giúp chất nền bằng cách cung cấp bề mặt cho phản ứng xảy ra. Enzyme bao gồm các không gian rỗng chiếm các nhóm như -SH, -COOH, và các nhóm khác ở bề mặt ngoài. Chất nền có điện tích trái dấu của enzim sẽ phù hợp với những không gian này, giống như một chiếc chìa khóa vừa với ổ khóa. Vị trí liên kết cơ chất này được gọi là vị trí hoạt động của enzym (E).
Mô hình thuận lợi của tương tác enzyme-cơ chất được gọi là mô hình cảm ứng-phù hợp. Mô hình này nói rằng tương tác giữa cơ chất và enzym là yếu, và những tương tác yếu này gây ra sự thay đổi cấu trúc nhanh chóng và tăng cường liên kết và đưa các vị trí xúc tác đủ gần với các liên kết cơ chất.
Có bốn cơ chế chính của xúc tác:
Xúc tác bởi Bond Strain
Sự sắp xếp lại cấu trúc gây ra trong loại xúc tác này tạo ra các liên kết cơ chất căng thẳng để đạt được trạng thái chuyển tiếp dễ dàng hơn. Cấu trúc mới buộc các nguyên tử chất nền và các nhóm xúc tác như aspartate vào các cấu trúc làm căng các liên kết chất nền.
Xúc tác cộng hóa trị
Cơ chất được định hướng đến vị trí hoạt động trên các enzym theo cách mà chất trung gian cộng hóa trị phát triển giữa enzym và cơ chất, trong quá trình xúc tác xảy ra theo cơ chế cộng hóa trị. Ví dụ tốt nhất về điều này liên quan đến sự phân giải protein bằng các protease serine có cả enzym tiêu hóa và các enzym khác nhau của dòng thác đông máu. Các protease này sở hữu serine vị trí hoạt động mà hydroxyl nhóm R tạo ra liên kết cộng hóa trị với cacbon cacbonyl của liên kết peptit và dẫn đến thủy phân liên kết peptit.
Xúc tác liên quan đến axit và bazơ
Các cơ chế khác bổ sung vào việc hoàn thành các sự kiện xúc tác được tạo ra bởi các cơ chế biến dạng chẳng hạn như việc sử dụng glutamate làm chất xúc tác axit nói chung.
Xúc tác bằng định hướng và tiệm cận
Tương tác enzym-cơ chất tạo ra các nhóm phản ứng gần nhau. Ngoài ra, các nhóm như aspartate có phản ứng hóa học, và sự gần gũi của chúng đối với chất nền tạo điều kiện cho chúng tham gia vào quá trình xúc tác.
Hành động và Bản chất của Enzyme
Một khi cơ chất (S) liên kết với vị trí hoạt động này, chúng tạo thành một phức hợp (trung gian-ES), sau đó tạo ra sản phẩm (P) và enzyme (E). Cơ chất được gắn vào enzym có cấu trúc cụ thể và chỉ có thể phù hợp với một loại enzym cụ thể. Do đó, bằng cách cung cấp bề mặt cho cơ chất, một enzym làm chậm năng lượng hoạt hóa của phản ứng. Trạng thái trung gian mà cơ chất liên kết với enzim được gọi là trạng thái chuyển tiếp. Bằng cách phá vỡ và tạo ra các liên kết, cơ chất liên kết với enzyme (không thay đổi), chất này chuyển thành sản phẩm và sau đó phân tách thành sản phẩm và enzyme. Các enzym tự do sau đó liên kết với các cơ chất khác và chu trình xúc tác tiếp tục cho đến khi phản ứng hoàn thành.
Hoạt động của enzym về cơ bản xảy ra theo hai bước:
Bước 1: Kết hợp enzyme và chất phản ứng / cơ chất.
E + S → [ES]
Bước 2: Sự phân rã của phân tử phức tạp để tạo ra sản phẩm.
[ES] → E + P
Do đó, toàn bộ hoạt động xúc tác của các enzym được tóm tắt là:
E + S → [ES] → [ EP] → E + P
Chất xúc tác sinh học
Chất xúc tác là những chất đóng một vai trò quan trọng trong phản ứng hóa học. Xúc tác là hiện tượng tốc độ của một phản ứng hóa học được thay đổi / tăng cường mà không tự thay đổi. Trong một phản ứng hóa học, chất xúc tác không thay đổi cả về lượng và tính chất hóa học. Enzyme là một trong những chất xúc tác thường được gọi là chất xúc tác sinh học. Enzyme có trong cơ thể sống tăng cường tốc độ phản ứng diễn ra trong cơ thể.
Các chất xúc tác sinh học, các enzym, là những chất cực kỳ cụ thể để xúc tác một phản ứng hóa học đơn lẻ hoặc một số phản ứng liên kết chặt chẽ. Cấu trúc chính xác của enzym và vị trí hoạt động của nó quyết định tính đặc hiệu của enzym. Các phân tử cơ chất tự gắn vào vị trí hoạt động của một enzym. Ban đầu, các chất nền tự liên kết với nhau bằng các tương tác không cộng hóa trị với các enzym bao gồm các liên kết ion, liên kết hydro và các tương tác kỵ nước. Enzyme làm giảm các phản ứng và năng lượng hoạt hóa để tiến tới trạng thái cân bằng nhanh hơn các phản ứng không được xúc tác. Cả tế bào nhân thực và tế bào nhân sơ thường sử dụng cơ chế điều hòa allosteric để đáp ứng với những biến động của trạng thái bên trong tế bào.
Bản chất của hoạt động của enzyme và các yếu tố ảnh hưởng đến hoạt động của enzyme được thảo luận dưới đây.
Các yếu tố ảnh hưởng đến hoạt động của enzym
Điều kiện của phản ứng có ảnh hưởng lớn đến hoạt động của các enzym. Enzyme đặc biệt về các điều kiện tối ưu được cung cấp cho các phản ứng như nhiệt độ, pH, sự thay đổi nồng độ cơ chất, v.v.

Thông thường, các hoạt động của enzym được tăng tốc khi nhiệt độ tăng. Vì các enzym có chức năng trong tế bào nên điều kiện khả thi đối với hầu hết các enzym là nhiệt độ vừa phải. Ở nhiệt độ cao hơn, cho một điểm cụ thể, có sự giảm mạnh hoạt động với sự biến tính của các enzym. Trong dung dịch pha loãng, các enzym tinh khiết biến tính nhanh chóng so với các enzym trong dịch chiết thô. Sự biến tính của enzym cũng có thể xảy ra khi enzym được ủ trong thời gian dài. Thích hợp hơn là sử dụng khoảng thời gian ngắn hơn khi đến thời gian ủ để đánh giá vận tốc bắt đầu của các phản ứng enzym như vậy.
Liên minh Hóa sinh Quốc tế đề nghị nhiệt độ xét nghiệm tiêu chuẩn là 30 ° C. Hầu hết tất cả các enzym đều cực kỳ nhạy cảm với sự thay đổi pH. Chỉ một số enzym hoạt động khả thi với độ pH trên 9 và dưới 5. Hầu hết các enzym đều có độ pH – tối ưu gần với mức trung tính. Bất kỳ sự thay đổi nào của pH đều làm thay đổi trạng thái ion của dư lượng axit amin trong toàn bộ protein và ở vị trí hoạt động. Các biến đổi ở trạng thái ion có thể thay đổi xúc tác và liên kết cơ chất. Sự ưa thích của nồng độ cơ chất là rất quan trọng vì ở nồng độ thấp hơn, tốc độ được điều khiển bởi nồng độ, tuy nhiên, ở nồng độ cao, tốc độ không phụ thuộc vào bất kỳ sự gia tăng nào của nồng độ cơ chất.
hoạt động
Sự xúc tác của enzym phụ thuộc vào hoạt động của các chuỗi bên axit amin được tập hợp trong trung tâm hoạt động. Enzyme liên kết chất nền vào một vùng của vị trí hoạt động trong một cấu trúc trung gian.
Thông thường, vị trí hoạt động là một khe hở hoặc một túi được tạo ra bởi các axit amin tham gia xúc tác và liên kết cơ chất. Các axit amin tạo thành vị trí hoạt động của enzyme không tiếp giáp với vị trí khác dọc theo trình tự của axit amin chính. Các axit amin ở vị trí hoạt động được lắp ráp thành cụm theo đúng cấu trúc bằng cách gấp 3 chiều của trình tự axit amin sơ cấp. Các gốc axit amin hoạt động thường xuyên nhất trong số 20 axit amin tạo thành protein là axit amin phân cực, aspartate, cysteine, glutamate, histidine, Serine và lysine. Thông thường, chỉ có 2-3 gốc axit amin thiết yếu tham gia trực tiếp vào liên kết gây ra sự hình thành sản phẩm. Glutamate, Aspartate và histidine là các gốc axit amin cũng đóng vai trò như một chất nhận hoặc cho proton.
Nhiệt độ và độ pH
Enzyme yêu cầu nhiệt độ và độ pH tối ưu cho hoạt động của chúng. Nhiệt độ hoặc độ pH mà tại đó một hợp chất cho thấy hoạt động tối đa của nó được gọi là nhiệt độ tối ưu hoặc pH tối ưu, tương ứng. Như đã đề cập trước đó, enzyme là các hợp chất protein. Nhiệt độ hoặc pH cao hơn mức tối ưu có thể làm thay đổi cấu trúc phân tử của các enzym. Nói chung, độ pH tối ưu cho các enzym được coi là nằm trong khoảng từ 5 đến 7.
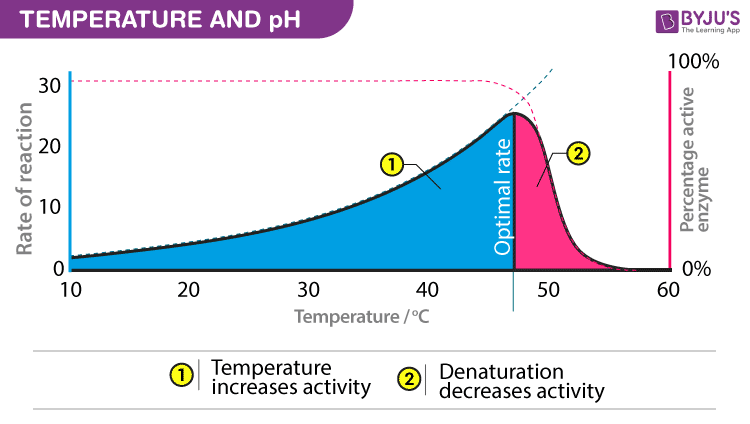
- T ° tối ưu
- Số vụ va chạm phân tử lớn nhất
- enzym của con người = 35 ° – 40 ° C
- nhiệt độ cơ thể = 37 ° C
- Nhiệt: tăng vượt quá T ° tối ưu
- Mức năng lượng tăng lên của phân tử phá vỡ các liên kết trong enzym & giữa enzym và cơ chất H, ion = liên kết yếu
- Biến tính = làm mất hình dạng 3D (cấu trúc 3 °)
- Lạnh: giảm T °
- Các phân tử di chuyển chậm hơn làm giảm va chạm giữa enzyme và cơ chất
Nồng độ và loại chất nền
Enzyme có một điểm bão hòa, tức là, một khi tất cả các enzyme được thêm vào đều bị chiếm bởi các phân tử cơ chất, hoạt động của nó sẽ ngừng lại. Khi phản ứng bắt đầu, tốc độ hoạt động của enzyme tiếp tục tăng khi bổ sung thêm cơ chất. Tuy nhiên, tại điểm bão hòa mà số lượng phân tử cơ chất nhiều hơn số lượng enzyme tự do, vận tốc vẫn giữ nguyên.
Loại cơ chất là một yếu tố khác ảnh hưởng đến hoạt động của enzym. Các chất hóa học gắn vào vị trí hoạt động của enzym có thể ức chế hoạt động của enzym và cơ chất đó được gọi là chất ức chế. Chất ức chế cạnh tranh là các chất hóa học cạnh tranh với cơ chất cụ thể của enzym cho vị trí hoạt động. Chúng có cấu trúc giống với cơ chất cụ thể của enzym và liên kết với enzym và ức chế hoạt động của enzym. Khái niệm này được sử dụng để điều trị các bệnh truyền nhiễm do vi khuẩn.
Nồng độ muối
Thay đổi độ mặn: Thêm hoặc loại bỏ cation (+) & anion (-)
- Phá vỡ liên kết, phá vỡ hình dạng 3D
- Làm gián đoạn sự hấp dẫn giữa các axit amin tích điện
- Ảnh hưởng đến cấu trúc 2 ° & 3 °
- Protein biến tính
- Enzyme không chịu được độ mặn cực cao
- Biển Chết được gọi là chết vì một lý do
Chức năng của Enzyme
Các enzym thực hiện một số chức năng trong cơ thể chúng ta. Bao gồm các:
- Enzyme giúp truyền tín hiệu. Enzyme phổ biến nhất được sử dụng trong quá trình này bao gồm protein kinase xúc tác quá trình phosphoryl hóa protein.
- Chúng phá vỡ các phân tử lớn thành các chất nhỏ hơn mà cơ thể có thể dễ dàng hấp thụ.
- Chúng giúp tạo ra năng lượng trong cơ thể. ATP synthase là các enzym tham gia vào quá trình tổng hợp năng lượng.
- Enzyme chịu trách nhiệm cho sự di chuyển của các ion qua màng sinh chất.
- Enzyme thực hiện một số phản ứng sinh hóa, bao gồm oxy hóa, khử, thủy phân, vv để loại bỏ các chất không dinh dưỡng ra khỏi cơ thể.
- Chúng có chức năng tổ chức lại cấu trúc bên trong của tế bào để điều hòa các hoạt động của tế bào.